*仅供医学专业人士阅读参考牛掌柜
T-DXd迎来HER2阳性早期治疗领域“首秀”,DB05与DB11双双告捷,引领HER2阳性早期乳腺癌迈向治愈新时代。
在刚刚落幕的2025年欧洲内科学会(ESMO)年会上,两项划时代的Ⅲ期研究——DESTINY-Breast11(DB11)与DESTINY-Breast05(DB05)同步公布结果,分别覆盖术前新辅助与术后辅助强化两大关键环节。研究结果显示:DB11证实在既往未经治的HER2阳性高危患者中,德曲妥珠单抗(T-DXd)序贯紫杉类+曲妥珠单抗+帕妥珠单抗(THP)方案(T-DXd-THP),较剂量密集多柔比星和环磷酰胺(ddAC)序贯THP方案(ddAC-THP)显著提升了11.2%的病理完全缓解(pCR)率且安全性更优;DB05则证实,在新辅助治疗后仍存在残余病灶的HER2阳性高危患者中,T-DXd成功挑战了当前恩美曲妥珠单抗(T-DM1)标准治疗,3年无侵袭性疾病生存(IDFS)率达92.4%,可将复发或死亡风险降低53%(HR=0.47,P<0.0001)。这两项研究的成功,不仅确立了T-DXd在HER2阳性早期乳腺癌新辅助与辅助强化治疗中的价值,更标志着抗体偶联药物(ADC)从晚期“延长生存”逐步迈向早期“治愈”。
值此之际,医学界特邀北京大学肿瘤医院范照青教授,深入解读DB05与DB11两项研究的关键结果,探讨T-DXd方案治疗在HER2阳性早期乳腺癌临床实践中的深远意义与未来方向。
HER2阳性乳腺癌的治疗困境与未尽之需
HER2阳性乳腺癌一种由HER2过度表达驱动的侵袭性疾病,约占所有乳腺癌患者的15%-20%,具有较强的复发倾向,长期以来被视为乳腺癌中“最难治”的亚型之一[1]。得益于抗HER2靶向药物的持续创新,HER2阳性乳腺癌的整体预后已得到显著改善[2]。对于早期患者而言,通过新辅助治疗实现降期手术、再辅以术后强化辅助治疗,已成为规范化、循证化的治疗路径。
在这一体系中,实现新辅助治疗后的pCR是长期生存获益的早期预测指标[3]。在过去十余年的探索中,得益于NeoSphere、PHARE以及TRAIN-2等一系列研究的不断探索,“双靶联合化疗”作为新辅助阶段的标准策略逐渐确立,使患者的pCR率显著提升至30%~60%,奠定了抗HER2新辅助治疗在早期乳腺癌中的核心地位[4-6]。然而对于HR阳性、肿瘤负荷大或淋巴结广泛阳性等高危人群,pCR率依然不理想,意味着仍有相当一部分患者在术后面临较高的复发风险,长期生存改善有限。同时,传统化疗方案的毒性负担不容忽视,,如蒽环类药物可导致心脏毒性及继发性白血病;紫杉类与铂类药物亦常引起骨髓抑制、神经病变与肾毒性,显著影响患者治疗依从性与远期生活质量。
此外,新辅助疗效也直接决定术后治疗策略的抉择。KATHERINE研究奠定了T-DM1作为新辅助治疗后未达pCR(non-pCR)患者的辅助强化标准方案,显著改善了non-pCR患者的预后,7年IDFS率达到80.8%,相较曲妥珠单抗组显著提升13.7%(80.8% vs 67.1%,HR=0.54),同时在总生存期(OS)方面也展现了优势(7年OS率:89.1% vs 84.4%,HR=0.66)。但进一步分析提示,T-DM1在初始不可手术及新辅后淋巴结阳性(ypN+)患者的7年IDFS率和OS率均低于总体人群,且并未减少中枢神经系统(CNS)复发的风险(T-DM1:7.0% vs. 5.1%)[7,8]。可见,即使在抗HER2靶向治疗联合化疗新辅助与T-DM1辅助强化治疗的加持下,部分高危患者仍难以获得持久的疾病控制。
由此可见,HER2阳性早期乳腺癌的治疗仍面临着多重困境:如何在不增加毒性负担的前提下实现更深层次的病理缓解?如何在高危人群中进一步降低复发风险并延长生存?又如何在兼顾疗效与生活质量的同时,真正实现“治愈”?
DB05/DB11突破:T-DXd引领HER2阳性早期乳腺癌“治愈”新程
在此背景下,今年ESMO大会的主席研讨会上公布的两项重磅Ⅲ期研究——DESTINY-Breast05(DB05)与DESTINY-Breast11(DB11)[9.10],标志着新一代ADC药物T-DXd正式进军HER2阳性早期乳腺癌领域。这两项研究分别聚焦新辅助阶段与术后辅助强化阶段,为优化早期高危患者的治疗路径提供了坚实的循证依据。
▌DB11:新辅助阶段的疗效提升与毒性优化
DB11是一项全球、多中心、随机、开放标签的大型III期研究,旨在评价T-DXd单药或T-DXd-THP方案作为新辅助治疗与标准治疗方案相比在高危(淋巴结阳性[N1-3]或原发肿瘤分期T3-4期)局部晚期或炎性HER2阳性早期乳腺癌患者中的疗效和安全性。患者以1:1:1的比例随机接受8个周期T-DXd单药治疗、4个周期T-DXd序贯4个周期THP治疗或4个周期ddAC序贯4个周期THP治疗。主要终点是pCR率(乳腺及淋巴结无浸润性病灶[ypT0/Tis ypN0]),次要终点包括无事件生存期(EFS)、IDFS、OS和安全性等,额外结局分析指标残余癌负荷(RCB)。
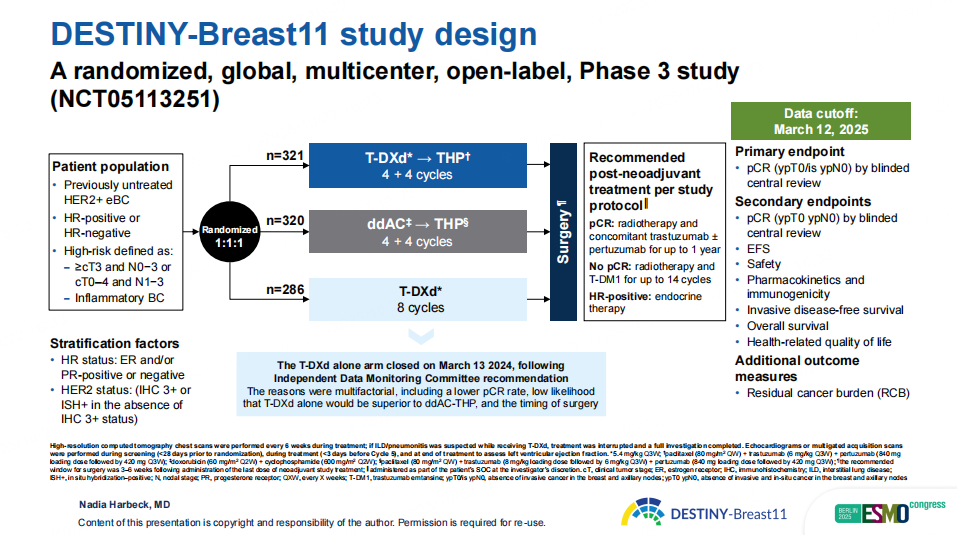
图1 DB11研究设计
研究结果显示,在意向治疗分析(ITT)人群中,T-DXd-THP组pCR率为67.3%,显著高于ddAC-THP组的56.3%(绝对获益为11.2%,p=0.003)为患者带来了具有显著统计学意义和临床意义的改善。在大多数预先设定的亚组中,T-DXd-THP组pCR率均优于ddAC-THP组,尤其是HR阴性(83.1% vs 67.1%)、淋巴结阳性(68.3% vs. 56.6%)、IIIB-IIIC期(72.2% vs. 55.7%)以及IHC2+人群(42.5% vs. 16.7%),pCR获益优势更为显著。此外,T-DXd-THP组81.3%的患者术后仅残留RCB 0-1级病灶(对照组为69.1%),显示其在降低残留肿瘤负荷方面同样具有明显优势。
早期EFS分析显示,T-DXd-THP组12个月EFS率为96.9%,较对照组93.1%呈积极趋势(HR=0.56,95%CI 0.26-1.17,EFS事件成熟度4.5%)。安全性方面,T-DXd-THP组较ddAC-THP组更优,≥3级不良事件(AE)、严重AE、导致剂量中断AE发生率更低,血液学AE、左室功能障碍、乏力发生率均更低。两组间质性肺病(ILD)发生率相似且均较低(4.4% vs. 5.1%),T-DXd-THP组≥3级ILD发生率仅0.6%。
此外,本次也披露了T-DXd单药组(n=286)数据,pCR率为43%,提示若缺乏更优的患者筛选方法,仅将ADC作为化疗药物唯一来源,对高危HER2阳性早期乳腺癌的新辅助治疗是不充分的。该组已在独立数据监测委员会(IDMC)建议下提前终止,原因包括pCR率较低、T-DXd单药显著优于ddAC-THP的可能性有限,以及手术时间安排等。
(关键数据见下文框内)
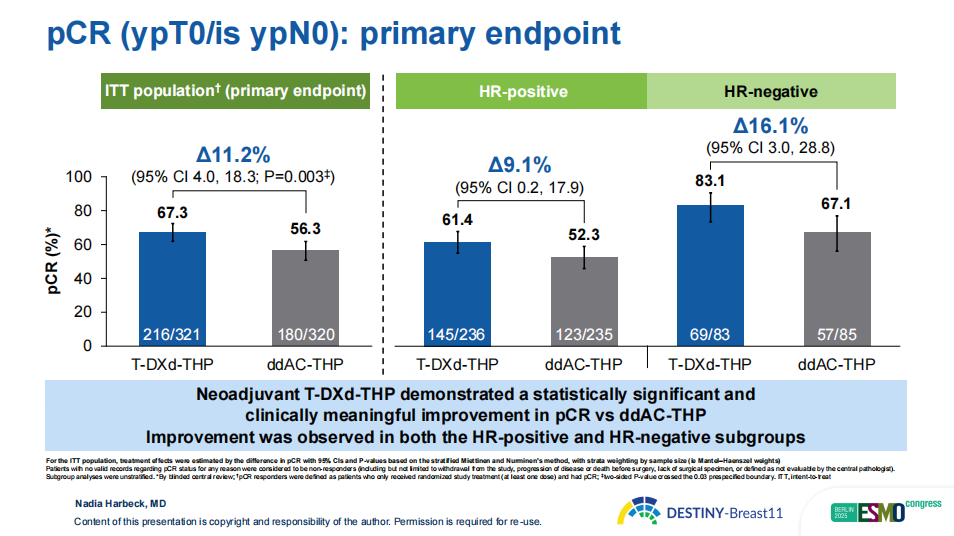
图2 DB11研究主要终点pCR结果
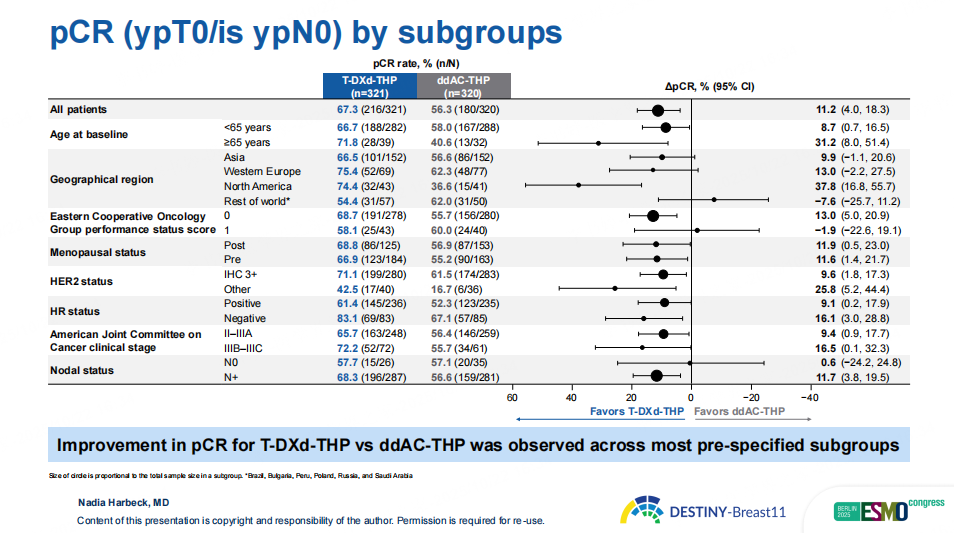
图3 DB11研究关键亚组pCR结果
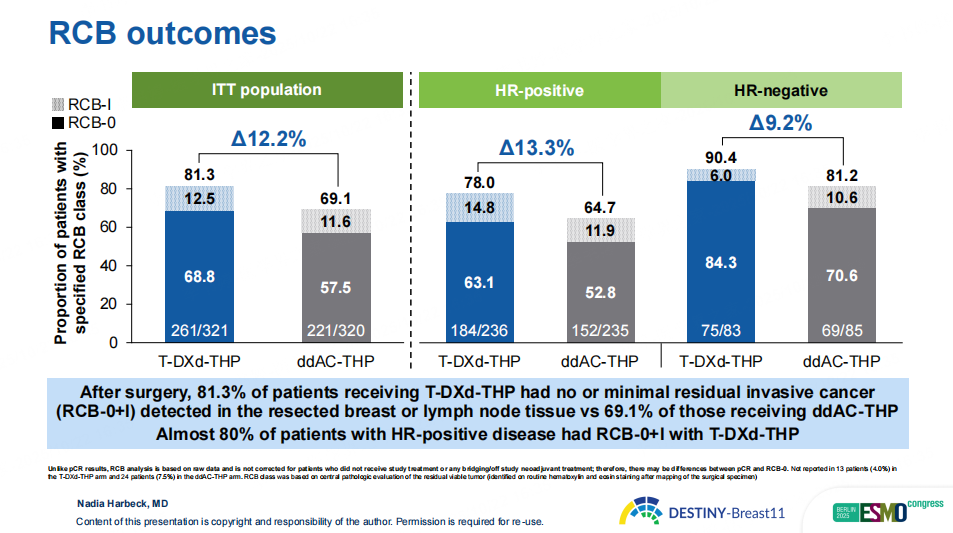
图4 DB11研究结局分析指标RCB结果
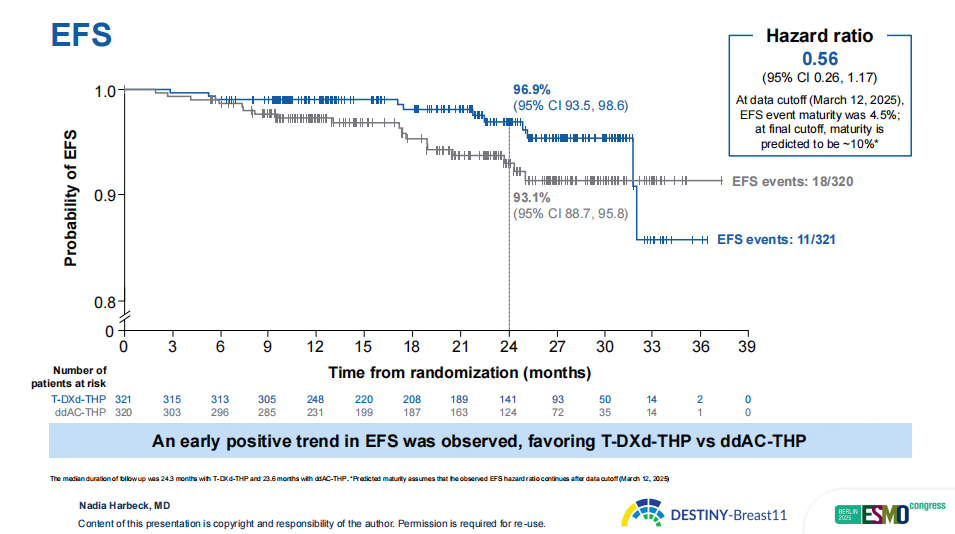
图5 DB11研究EFS获益趋势
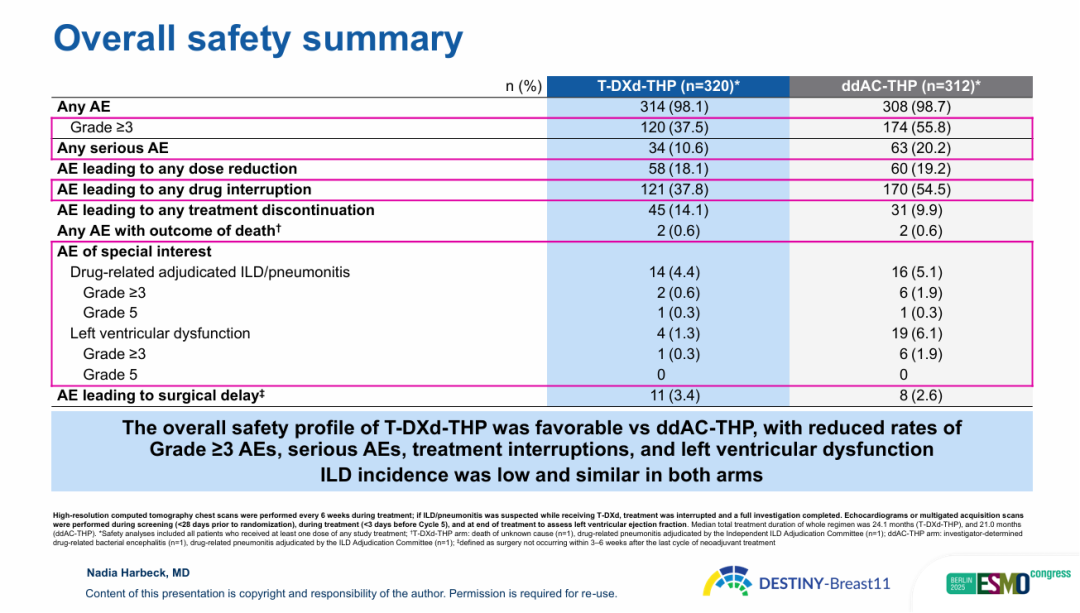
图6 DB11研究安全性分析
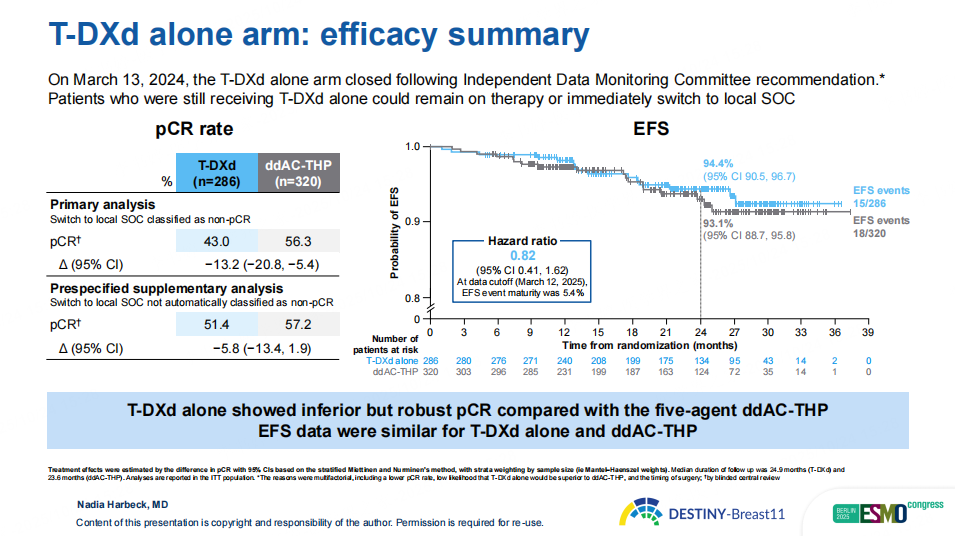
图7 DB11研究T-DXd单药组结果
(左右滑动查看)
DB11以“去蒽环、提疗效、降毒性”的策略,刷新了目前HER2阳性乳腺癌新辅助治疗的pCR上限并改善安全性,为高危HER2阳性患者提供了更高效、更安全的新辅助方案。
▌DB05:T-DXd强效引领辅助强化治疗新标准
DB05研究是一项全球多中心、随机、开放性、Ⅲ期研究,旨在评估T-DXd与T-DM1在新辅助治疗后仍存在残留浸润性病灶的高危HER2阳性原发性乳腺癌患者辅助治疗中的疗效与安全性。高危定义为新辅助治疗前出现以下情况:不可手术早期乳腺癌(cT4,N0-3,M0或cT1-3,N2-3,M0)或可手术早期乳腺癌(cT1-3,N0-1)但在新辅助化疗后腋窝淋巴结阳性(ypN1-3)。
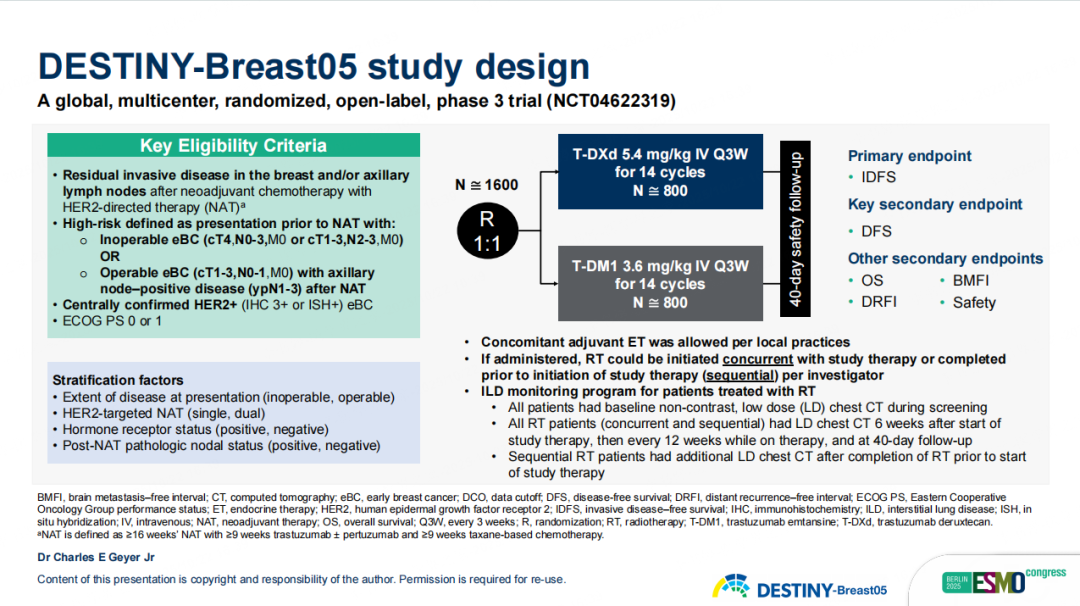
图8 DB05研究设计
T-DXd在主要终点IDFS上取得了统计学和临床意义的显著改善。与T-DM1相比,T-DXd将疾病复发或死亡风险降低了53%(HR 0.47,95%CI 0.34-0.66,p<0.0001)。3年IDFS率分别为92.4% vs. 83.7%,绝对获益达8.7%。且这种获益趋势在所有预设亚组中保持一致,无论年龄、人种情况、所在区域、激素受体状态、新辅助治疗前的疾病状态、淋巴结状态、使用单靶或双靶新辅助方案、是否接受放射治疗,T-DXd组均表现出一致获益。
次要终点结果同样令人鼓舞:在无病生存期(DFS)上,T-DXd实现了8.8%的绝对获益,3年DFS率达到92.3% vs. 83.5%(HR 0.47,95%CI 0.34-0.66,p<0.0001)。在无远处复发生存期(DRFI)、无脑转移生存期(BMFI)、OS方面,T-DXd也带来显著改善:3年DRFI率为93.9% vs 86.1%(HR 0.49,95% CI 0.34-0.71),绝对获益7.8%;3年BMFI率为97.6% vs 95.8%(HR 0.64,95% CI 0.35-1.17),T-DXd组出现中枢神经系统转移及死亡人数较少,提示T-DXd治疗可能具有一定的中枢保护作用;尽管随访OS成熟度仅为2.9%,但已观察到获益趋势(HR 0.61,95% CI 0.34-1.10),3年OS率为97.4% vs 95.7%。
安全性方面,T-DXd治疗安全性可控,整体耐受性与T-DM1相当,没有新的安全信号出现。T-DXd治疗组中报告9.6%患者为药物相关ILD,多数为1-2级且可逆(≥3级仅1%)牛掌柜,在规范监测和早期干预下风险可控。
(关键数据见下文框内)
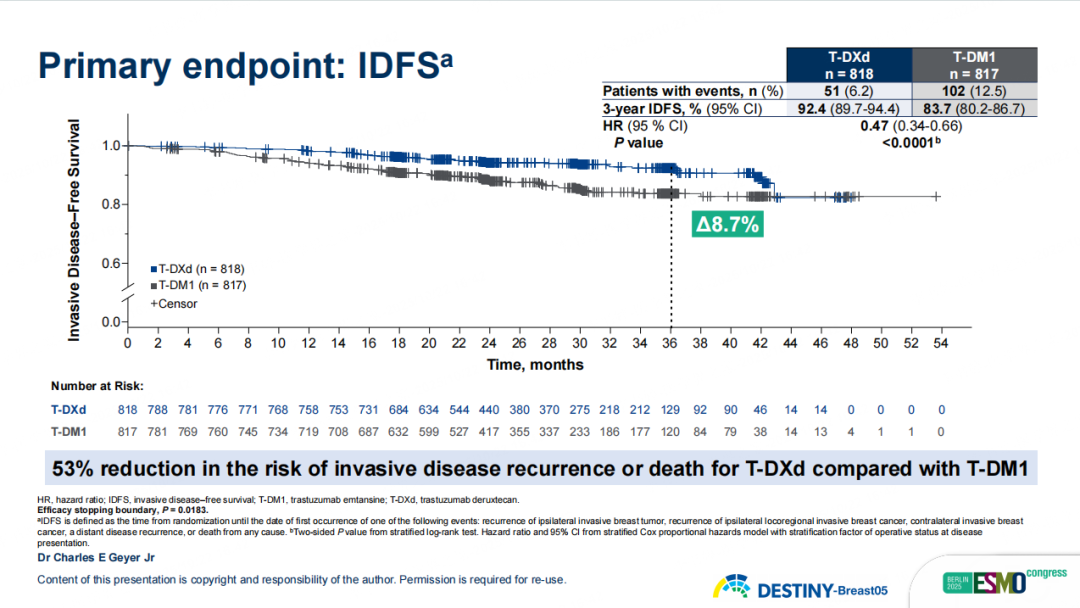
图9 DB05研究主要终点IDFS结果
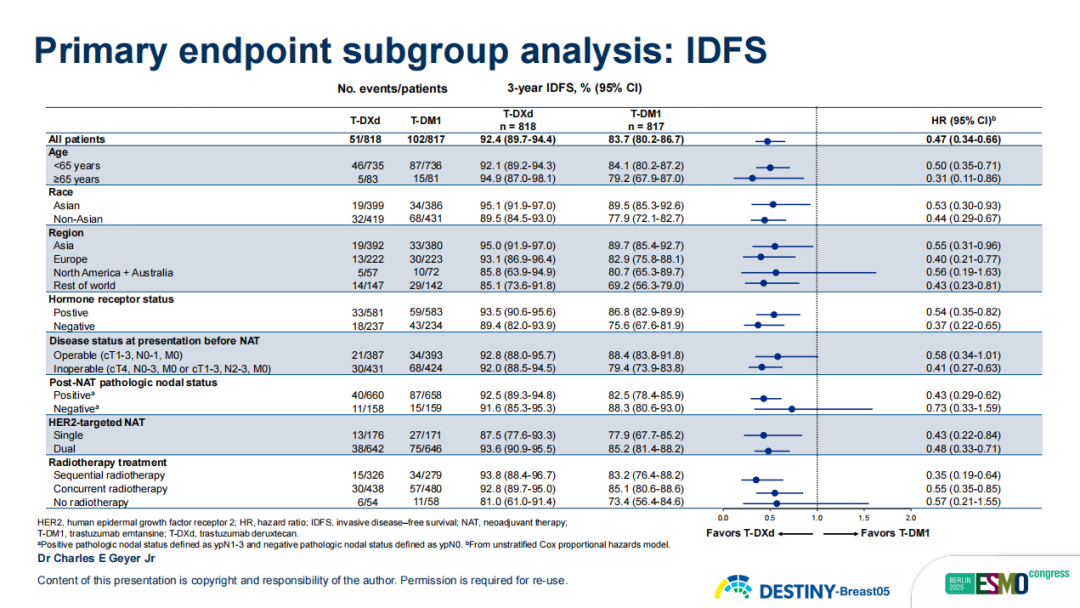
图10 DB05研究关键亚组IDFS结果

图11 DB05研究首次IDFS事件分析结果
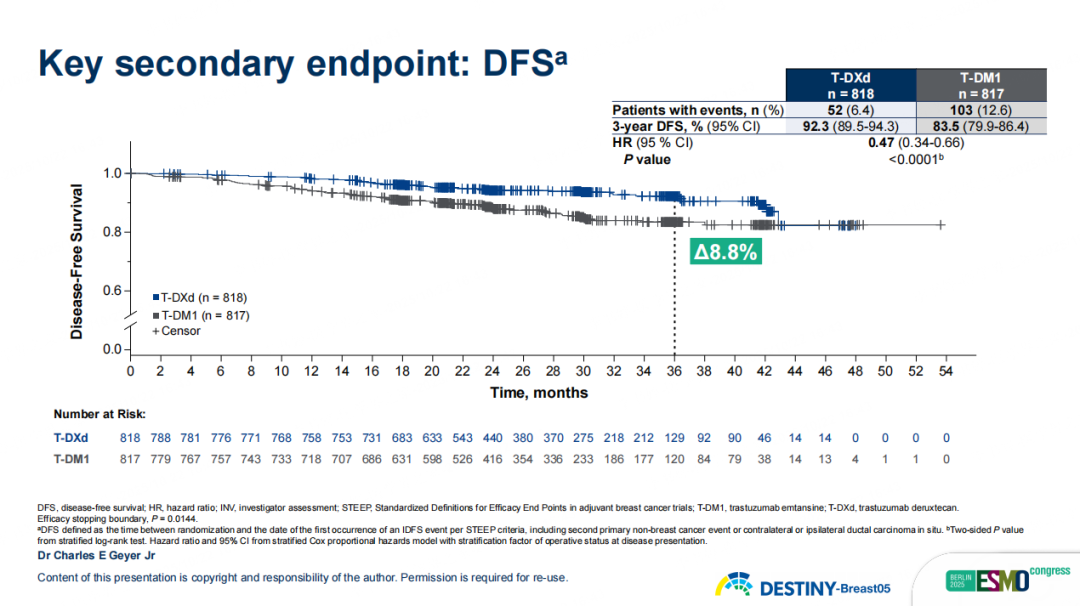
图12 DB05研究关键次要终点DFS结果
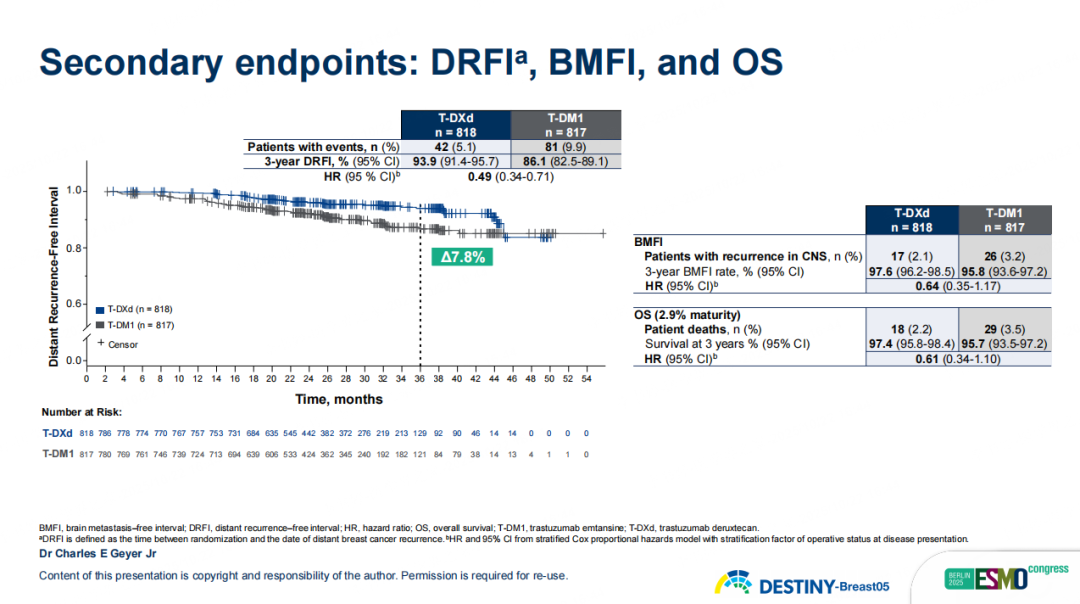
图13 DB05研究次要终点DRFI、BMFI和OS结果
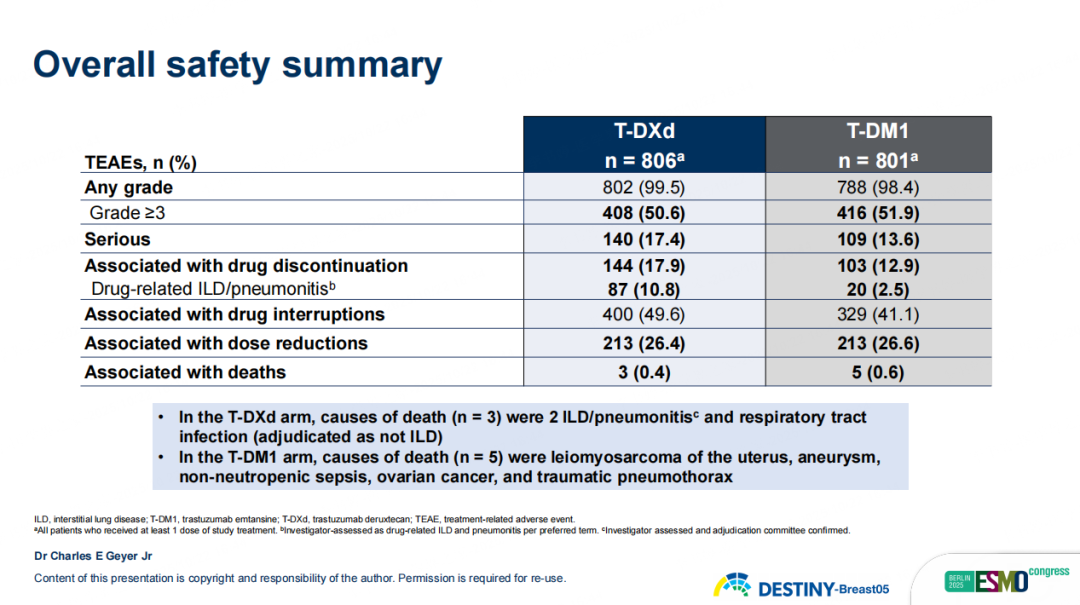
图14 DB05研究安全性分析结果
(左右滑动查看)
DB05的结果有望成为HER2阳性早期乳腺癌辅助强化治疗领域的重要里程碑之一。在新辅助治疗后仍存在残余病灶的non-pCR患者中,T-DXd不仅在主要终点上实现了显著突破,同时在多项次要终点上均展现出一致的疗效优势,为早期患者实现治愈的目标提供了强有力的新选择。
HER2阳性早期乳腺癌个体化精准治愈:未来启新
随着DB11与DB05的双阳性结果公布,T-DXd在HER2阳性早期乳腺癌中实现了从新辅助到辅助强化的连续布局,形成“贯穿术前与术后”的治疗新格局。T-DXd的前移不仅拓展了ADC的应用边界,也让临床医生面临新的决策命题——当术前、术后均可使用T-DXd,我们应如何平衡时机、疗程与治疗策略。
▌术前与术后的抉择:整合DB05与DB11的新启示
在ESMO大会DB05研究的讨论环节中,Sara Tolaney教授指出,T-DXd在不同治疗阶段的应用各具优势。术前使用T-DXd的优势包括能提高pCR率,进而减少腋窝手术的需求。且治疗周期更短,仅需4个周期,相比术后可能需要的14个周期,患者承受的治疗时长更短,可能的毒性反应更少,生活质量也会更好。而术后使用T-DXd则为术后non-pCR患者提供了更强效的“补救性强化”方案,显著降低疾病复发风险,进一步接近“治愈”目标。未来,如何在术前与术后阶段整合T-DXd的应用模式,将成为早期HER2阳性乳腺癌管理的新焦点。
一种值得关注的方向是基于治疗反应的应答指导式(response-guided)策略——通过ctDNA动态监测与影像学评估疗效后进行分层:治疗应答者可接受短程T-DXd方案,以最少疗程获得最大pCR获益;治疗非应答者则可在辅助阶段及时调整治疗策略,序贯强化方案如AC-T-DM1,以提高病理缓解率与长期生存。这种基于治疗反应驱动的个体化路径有望实现“精准提效、适度降阶”,在疗效与安全性之间达到最佳平衡。
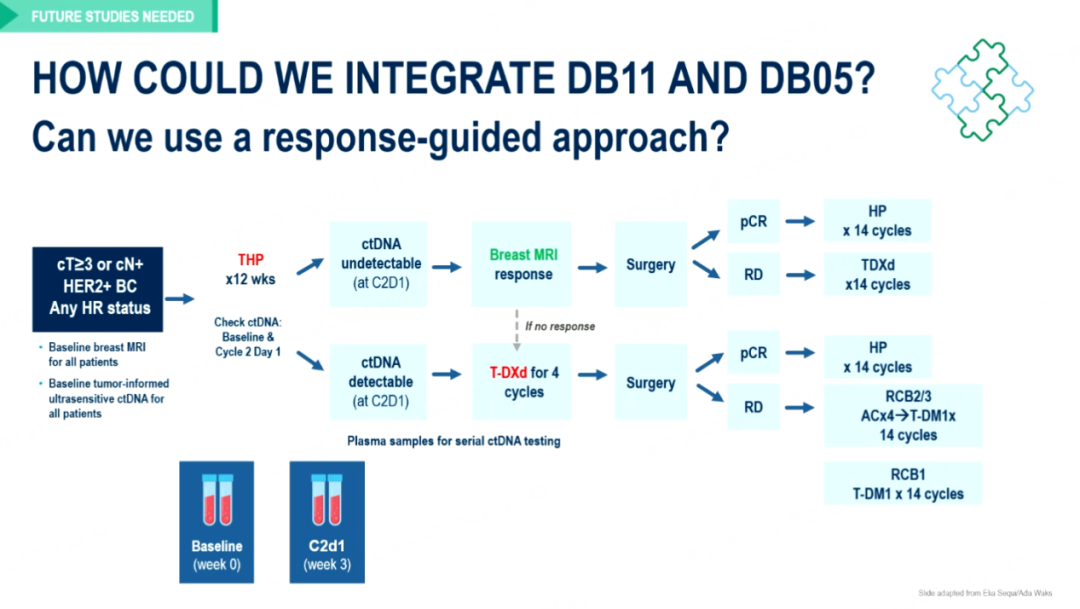
图15 基于DB11和DB05研究的治疗反应驱动策略模式
另一方面,对于术前已接受T-DXd治疗的患者,术后non-pCR人群的治疗选择仍存在争议。T-DM1能否在T-DXd之后继续发挥作用,是当前研究的关键问题之一。从机制层面看,T-DM1与T-DXd的有效载荷不同,理论上可能不存在交叉耐药性,但尚需更多临床证据验证。DAISY研究提示约65%的患者在T-DXd治疗后HER2表达水平下降[11],这可能削弱T-DM1在该人群中的疗效。因此,未来在non-pCR患者的管理中,应结合RCB分级与HER2表达变化,制定个体化治疗方案。
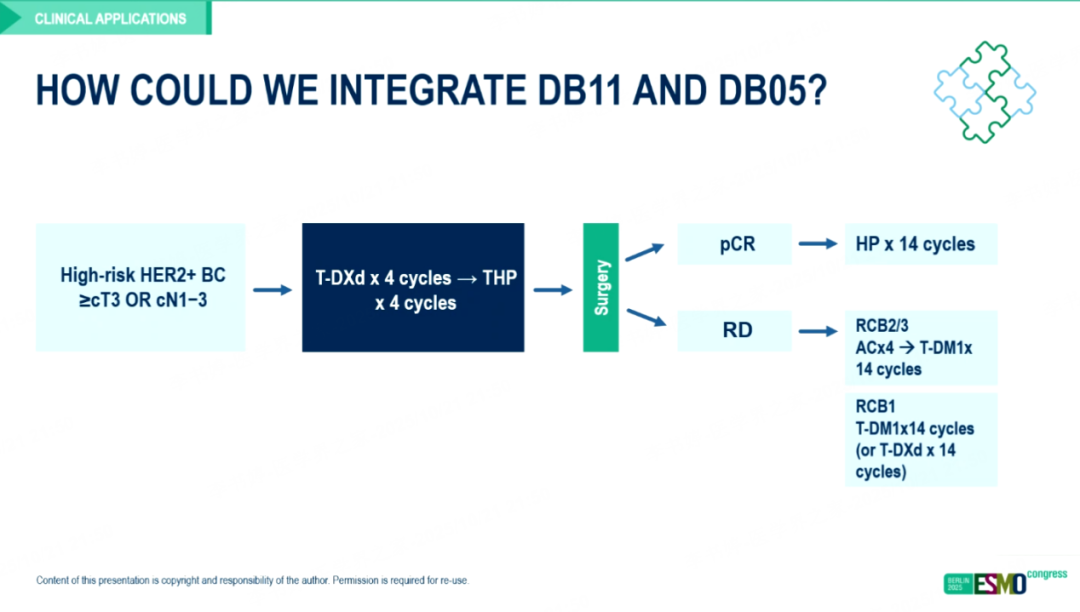
图16 新辅助应用DB11方案后non-pCR患者的个体化治疗路径
▌新辅助治疗的联合策略与治疗周期优化
在DB11研究中,T-DXd采用“4周期T-DXd序贯4周期THP”的设计,总疗程8个周期。虽然该方案在疗效和安全性方面均表现出良好的平衡,但对于部分患者而言,相对较长的治疗周期和多药联合方案仍带来一定治疗负担与依从性挑战。如何在维持疗效的情况下,进一步简化治疗强度和周期是重点探索的方向。
基于这一理念,正在进行的ADAPT-HER2-IV研究(NCT05704829)正尝试探索一种更加精简、高效的方案[12]。该研究拟评估4-6周期T-DXd±HP是否可以替代传统的4-6周期THP或TCbHP,以pCR率和IDFS为主要终点。这一研究的亮点在于——它将不仅验证T-DXd能否在短疗程中达到传统方案的疗效,还通过术后病理反应驱动的动态调整机制实现精准分层:达到pCR或接近完全缓解的患者可免除额外化疗,仅继续抗HER2±内分泌治疗;未达到pCR的患者则进入强化治疗阶段,以最大化长期获益。如果该研究获得积极结果,将为HER2阳性早期乳腺癌提供一种“免蒽环、免紫杉、免卡铂”且短程高效的辅助治疗新策略。
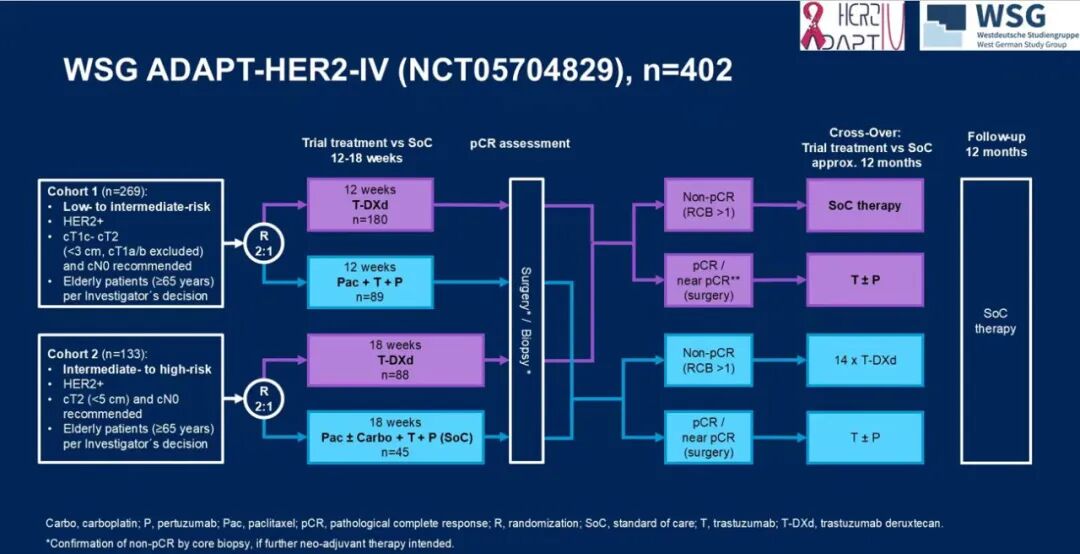
图17 ADAPT-HER2-IV研究设计
专家简介

范照青 教授
博士 主任医师 副教授 硕士研究生导师
北京大学肿瘤医院乳腺癌预防治疗中心副主任
中国抗癌协会乳腺癌专业委员会常务委员
中国医师协会外科医师分会乳腺外科专家工作组专家委员
中国医师协会肿瘤医师分会乳腺癌学组委员
中国医药教育协会理事、乳腺癌多学科诊疗学组主任委员
中国医疗保健国际交流促进会乳腺疾病分会常务委员
中国初级卫生保健基金会乳腺肿瘤专业委员会副主任委员
北京医学会乳腺疾病分会委员
北京癌症防治学会副理事长
专家点评:以治愈为导向的全程管理新纪元
备受瞩目的DB05和DB11两项大III期研究,在本届ESMO会议上双双取得了阳性结果,有望进一步优化当前HER2阳性早期乳腺癌的治疗格局。在辅助强化治疗领域,T-DXd组较T-DM1组显著降低了53%疾病复发或死亡风险(HR 0.47,95%CI 0.34-0.66,p<0.0001),3年IDFS率分别为92.4% vs. 83.7%,绝对获益达8.7%,且在各个亚组中保持了一致的获益趋势,这一结果有望使T-DXd成为HER2阳性早期乳腺癌辅助强化治疗优选方案。在新辅助阶段,T-DXd-THP组也刷新了pCR率的历史新高,达67.3%,较对照提升11.2%,这种不含蒽环的“高效低毒”方案也有望引领早期治疗格局的深刻变革。
更重要的是,这两项贯穿新辅助与辅助阶段研究构建了连续的证据体系,也为未来精准化、个体化的治疗策略奠定了科学基础。对于T-DXd在HER2阳性早期乳腺癌中使用时机,应结合这两项研究的入组人群特征、治疗目的、不良反应耐受性和药物可及性做出合理的临床决策。对于高危患者(T3-4或淋巴结阳性),可以考虑DB11的治疗策略,在新辅助阶段使用T-DXd,以获得更高的pCR率。对于非高危患者,则可以考虑DB05的策略,在强化辅助阶段使用T-DXd,改善non-pCR患者的生存。未来,借助ctDNA、影像学及RCB分层等生物学指标,或可实现基于疗效反应的动态决策:对早期应答者缩短疗程、降低强度,对高危或non-pCR人群实施强化或联合方案,从而在疗效与安全之间取得最优平衡。随着T-DXd在不同治疗阶段的不断前移,T-DXd也将助力更多的早期HER2阳性乳腺癌走向“治愈”的终点。
参考文献:
[1]中国临床肿瘤学会乳腺癌专家委员会,中国抗癌协会乳腺癌专业委员会. 人2阳性乳腺癌临床诊疗专家共识(2021版)[J]. 中华医学杂志,2021,101(17):1226-1231.
[2]Early Breast Cancer Trialists’ Collaborative group (EBCTCG). Trastuzumab for early-stage, HER2-positive breast cancer: a meta-analysis of 13 864 women in seven randomised trials. Lancet Oncol. 2021 Aug;22(8):1139-1150.
[3]Spring LM, et al. Pathologic Complete Response after Neoadjuvant Chemotherapy and Impact on Breast Cancer Recurrence and Survival: A Comprehensive Meta-analysis. Clin Cancer Res.2020;26:2838–2848.
[4]Gianni L, et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncol. 2012;13(1):25-32.
[5]Xavier P, et al. 6 months versus 12 months of adjuvant trastuzumab in early breast cancer (PHARE): final analysis of a multicentre, open-label, phase 3 randomised trial.[J]. The Lancet. 393:2591~98.
[6]van Ramshorst MS, et al. Neoadjuvant chemotherapy with or without anthracyclines in the presence of dual HER2 blockade for HER2-positive breast cancer (TRAIN-2):a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2018;19(12):16309.
[7]Geyer CE Jr, et al; KATHERINE Study Group. Survival with Trastuzumab Emtansine in Residual HER2-Positive Breast Cancer. N Engl J Med. 2025 Jan 16;392(3):249-257.
[8]Sibylle Loibl, et al.Phase III study of adjuvant ado-trastuzumab emtansine vs trastuzumab for residual invasive HER2-positive early breast cancer after neoadjuvant chemotherapy and HER2-targeted therapy: KATHERINE final IDFS and updated OS analysis. 2023 SABCS abstracts GS03-12.
[9]Charles G, et al. Trastuzumab deruxtecan (T-DXd) vs trastuzumab emtansine (T-DM1) in patients (pts) with high-risk human epidermal growth factor receptor 2–positive (HER2+) primary breast cancer (BC) with residual invasive disease after neoadjuvant therapy (tx): Interim analysis of DESTINY-Breast05. 2025 ESMO LBA1.
[10]Harbeck N, et al. DESTINY-Breast11: neoadjuvant trastuzumab deruxtecan alone or followed by paclitaxel + trastuzumab + pertuzumab vs ddAC-THP for high-risk HER2+ early breast cancer. 2025 ESMO. 291O.
[11]Mosele F, et al. Trastuzumab deruxtecan in metastatic breast cancer with variable HER2 expression: the phase 2 DAISY trial. Nat Med. 2023 Aug;29(8):2110-2120.
[12]Graeser M, et al. Prediction of survival after de-escalated neoadjuvant therapy in HER2+ early breast cancer: A pooled analysis of three WSG trials. 2025 ASCO. 502.
*此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场。
公牛配资提示:文章来自网络,不代表本站观点。